5.7. Poruchy příjmu potravy
Poruchy příjmu potravy mohou být kvantitativní (snížený nebo zvýšený příjem: hladovění nebo obezita) a kvalitativní (chybí nějaká živina, vitamín nebo stopový prvek).
5.7.1 Kvantitativní poruchy příjmu potravy
Nízký příjem potravy – podvýživa (malnutrice), hladovění
Podvýživa je způsobena nerovnováhou v příjmu a výdeji energie, kdy je příjem nebo vstřebávání energetických substrátů nižší než jejich potřeba. Taková nerovnováha může vzniknout při snížení příjmu potravy (např. při mentální anorexii), nebo při zvýšené potřebě energie a neměnícím nebo snižujícím se příjmu (např. při akutním onemocnění, při zvýšené tělesné námaze nebo při poruše trávicích a vstřebávacích procesů v těle).
Organismus začne čerpat energii z vlastních zásob. Změna metabolismu závisí na situaci a na době, po kterou změna metabolismu probíhá. Organismus se během hladovění chová různě v různých časových obdobích.
| Podvýživa (malnutrice) vzniká nedostatečným příjmem nebo nedostatečným trávením a vstřebáváním živin, případně zvýšenými metabolickými nároky organismu. Kachexie je pokročilý stav podvýživy, často bývá spojován s onemocněním, které je jeho příčinou (nádorová kachexie, kardiální kachexie). Často se snižuje pacientova hmotnost (nemusí být vždy, hmotnost bývá kompenzována retencí tekutin). Poslední stadium podvýživy se nazývá marasmus. Karence je nedostatek některého z důležitých nutričních faktorů (vitamínů, stopových prvků nebo esenciálních aminokyselin či mastných kyselin). |
Prosté hladovění
Krátkodobé hladovění (neadaptované, prosté), trvá většinou kolem tří dní, ale u někoho může trvat i mnohem delší dobu (zvlášť při opakovaném hladovění).
Energie je zpočátku kryta z posledního jídla. Poté se mírně sníží glykémie, na což reaguje glukagon a aktivuje glykogenolýzu (vrchol po 4 – 8 hodinách). Pokud hladovění pokračuje, zapojí se i aktivace sympatiku – zvýší se sekrece katecholaminů, které udržují glykogenolýzu v játrech a navíc pomáhají získat energii lipolýzou (uvolňují mastné kyseliny z triacylglycerolu). Metabolismus podpoří i druhá stresová osa zvýšením produkce kortizolu. Protože se postupně vyčerpávají zásoby glykogenu, nastupuje plná glukoneogeneze z laktátu, pyruvátu, glycerolu a aminokyselin (12 – 18 hodin po jídle). Kortizol má hlavně proteolytické, ale i lipolytické účinky. Glukoneogenezou z glukoplastických aminokyselin se tvoří glukóza. Postupně se zvýší glykémie, ale nová hodnota je nižší, než hodnota před začátkem hladovění.
Už několik hodin po posledním příjmu potravy se mohou objevit ketolátky v moči (přestože se jejich koncentrace v plazmě zatím nezvýšila).

Adaptované hladovění
Po několika dnech (většinou třech) nastupuje adaptace. Jestliže začne zdravý člověk hladovět (např. drží hladovku z politických důvodů; nachází se na místě, kde nemá přístup k potravě, nebo se u něj rozbíhá proces mentální anorexie), po třech dnech se jeho metabolismus sníženému příjmu potravy přizpůsobí a vyvine se tzv. „adaptované hladovění“.
Postupně se dále snižuje aktivita stresových os a odpadají glukoneogenetické a proteolytické účinky. Glukoneogeneza klesá k 1/3 původní úrovně, dále se snižuje glykémie a tím se snižuje i bazální sekrece inzulinu. Nedostatek inzulinu aktivuje metabolismus tuků směrem k lipolýze a tvorbě ketolátek (ketolátky se tvoří tehdy, když je v těle vysoká koncentrace glukagonu a nízká až nulová koncentrace inzulínu). Hlavním zdrojem energie se tak stávají tuky a ketolátky, které vznikají v játrech z mastných kyselin. Rozvíjí se ketoacidóza. Vzniklé ketolátky (acetoacetát, kyselina hydroxymáselná a aceton) se jediné zdroje energie kromě glukózy dají využít jako energie pro mozek (mohou pokrýt až 2/3 jeho energetické potřeby).
Adaptaci napomáhá i snížení sekrece hormonů štítné žlázy a přeměna již vyplaveného T3 na neúčinný rT3 (revertovaný T3) hormon, což sníží bazální metabolismus a tím i nároky tkáně na energii (až o 40 procent). Prodlouží se doba možného přežití.
Adaptované hladovění může být způsobeno mnoha mechanismy:
- mechanickými poruchami příjmu potravy (defektní chrup, špatná protéza),
- postižením slinných žláz, onemocněním dutiny ústní, hltanu, jícnu, trávicího traktu,
- intolerancí potravy při malabsorpčním syndromu,
- mentální anorexií a bulimií,
- poruchami příjmu potravy u některých psychiatrických onemocnění (schizofrenie s katatonním stuporem, těžké depresivní poruchy, demence, paranoia s odmítáním potravy, mentální anorexie).
Adaptované hladovění je charakterizované sníženým bazálním metabolismem a využitím tuků jako hlavního zdroje energie. Tento typ hladovění většinou trvá kolem 30 dní (záleží na výchozím množství tuku) a pak se, pokud se nezvýší příjem potravy, přeměňuje na stresové hladovění.

Stresový metabolismus, stresové hladovění
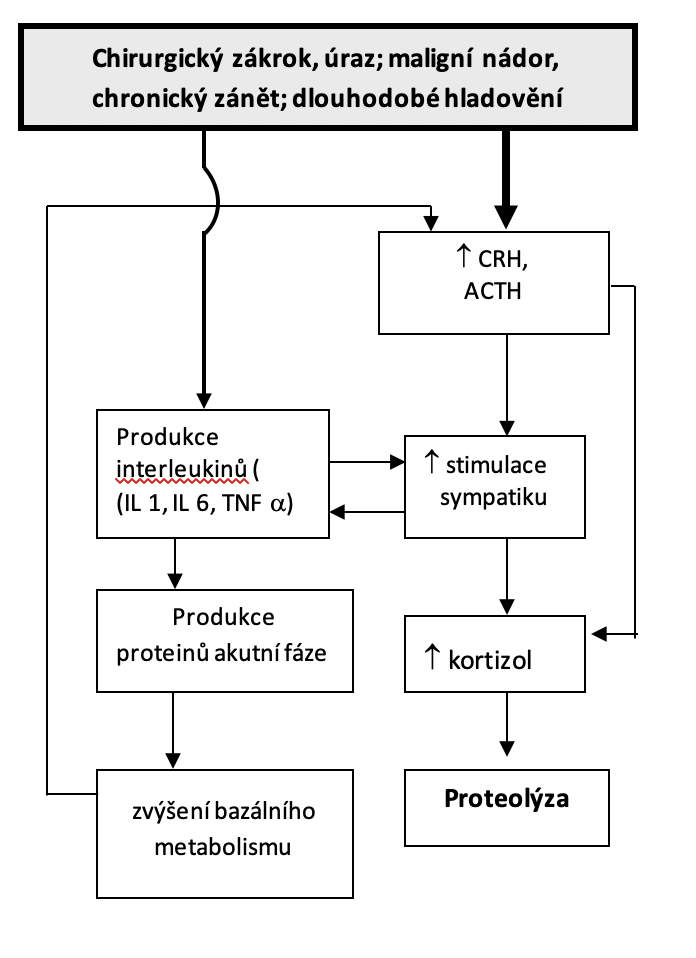
Stresový metabolismus je stav, při kterém se aktivují stresové osy v těle, zvyšuje se bazální metabolismus a kvůli glukoneogenezi (spuštěné zvýšením kortizolu) se ve velké míře odbourávají bílkoviny (hlavně z příčně pruhovaných svalů). Tato situace nastává krátkodobě po operacích či po úrazu. Může však nastat také zvýšením interleukinů produkovaných při chronickém zánětu nebo při onkologických onemocněních nebo při skutečném nedostatku živin po spotřebování tukových zásob dlouhodobějším hladověním.
Stresová odpověď je spouštěna buď přímo úrazem (bolest) nebo nepřímo zvýšením interleukinů (IL 1, IL6, TNF a) při reakci organismu. Zvýšená produkce kortizolu zvyšuje aktivitu sympatiku a výrazně potencuje proteolýzu. Bílkoviny se stávají hlavním zdrojem energie.
Vysoké hladiny interleukinů u maligních nádorů a chronických zánětů zvyšují sekreci CRH i ACTH a vysoká produkce obou hormonů zpětně udržuje vysokou koncentraci interleukinů. Situace je pro organismus bezvýchodná. Zvýšená sekrece mediátorů zánětu zvyšuje tvorbu proteinů akutní fáze, zvyšuje se bazální metabolismus v játrech a tím se zvyšují i nároky na množství energetického substrátu. Pokud se „circulus vitiosus“ ztrát bílkovin včas nezastaví, vede to k mnoha komplikacím a nakonec i ke smrti (viz tabulka Rizika spojená se ztrátou bílkovin). Při ztrátě 25 – 30 % základní proteinové masy je stav nevratný.
V této fázi hladovění jsou jediným zdrojem energie aminokyseliny z katabolizovaných proteinů. Postupně se spotřebovávají bílkoviny příčně pruhované svaloviny a později i bílkoviny srdce, jater nebo ledvin. Porucha orgánových funkcí vede až ke smrti pacienta.
| Poznámka: V prvních třech dnech hladovění se denně spotřebuje v metabolismu asi 75g bílkovin (odbourávají se především bílkoviny ze střevní sliznice, ve kterých je výrazně vyšší zastoupení glukoplastických aminokyselin). Při adaptovaném hladovění je ztráta kolem 20g/den (bílkoviny jsou chráněny jako důležité strukturní a funkční molekuly). Při stresovém hladovění se ztráty bílkovin významně zvyšují. První den stresového metabolismu po úrazu nebo chirurgickém zákroku se ztráty bílkovin u zdravého mladého muže pohybují kolem jednoho kilogramu za den. Po třech dnech však nastupuje hojení (anabolismus) a ztráty bílkovin se podstatně sníží. |
Důsledky hladovění
| Orgánový systém | Klinické důsledky | Mechanismus |
|---|---|---|
| Imunita | ↓ obranyschopnosti organismu | Nedostatek proteinů, vitamínů: ↓ tvorba protilátek, interleukinů, porucha dělení buněk |
| Zhoršení hojení ran a regenerace orgánů | Nedostatek proteinů, vitamínů potřebných k reparaci nebo regeneraci tkání | |
| Kardiovaskulární systém | Atrofie srdeční svaloviny | Spotřeba proteinů myokardu (v pozdních fázích) |
| Poruchy srdečního rytmu až zástava | Změny hladin iontů (hlavně K+), atrofie myokardu | |
| Plíce | Bronchopneumonie | Snížení svalové síly dýchacích svalů – hypoventilace, neschopnost odkašlat, snížená aktivita řasinkového aparátu |
| Termoregulace | Pokles tělesné teploty, zimomřivost | Snížený bazální metabolismus, nízký krevní tlak, vymizení izolační vrstvy podkožního tuku |
| Sexuální funkce | Pokles libida, u žen amenorea | Snížená sekrece pohlavních hormonů |
| Gastrointestinální trakt | Vodnaté průjmy | Atrofie střevní sliznice / Porucha exokrinní funkce pankreatu |
| Krvetvorba | Pancytopenie | Porucha dělení buněk |
| Různé typy anemií | Nedostatek bílkovin, avitaminózy (z nedostatečného přívodu a vstřebávání vitamínů), nedostatek železa a mědi | |
| Kosti | Osteoporóza a osteomalácie s rizikem zlomenin | Porucha iontového hospodářství: hypokalcémie, hypofosfatémie, hypomagnezémie, nedostatek bílkovin |
| Nervosvalový systém | Poruchy neuromuskulární dráždivosti (parézy) | Poruchy minerálového hospodářství: ↑exkrece K+ a Mg2+ |
| Centrální nervový systém | Atrofie mozkové kůry | |
| Epileptické záchvaty |
Kachexie
Kachexie je silná celková sešlost, chátrání a hubnutí organismu, spojené s výraznou slabostí. Je následkem dlouhodobých vážných onemocnění, hlavně zhoubných nádorů a těžkých infekcí.
Pojem kachexie bývá s termínem malnutrice zaměňován, ale používá se především v souvislosti s konkrétní příčinou podvýživy. Nejčastěji se používá v souvislosti s nádorovými onemocněními, u kterých se vyskytuje až v 50 procentech, a má značný podíl na morbiditě a mortalitě onkologicky nemocných. Příčiny jsou komplexní. Dominantní úlohu sehrává vlastní nádorové onemocnění, které ovlivňuje stav výživy přímo (např. karcinom jícnu), ale i produkovanými interleukiny (Tumor nekrotizující faktor α (TNFα)) s celkovými účinky, způsobujícími nádorovou anorexii (viz stresové hladovění). Metabolismus nádorových buněk je navíc energeticky náročný a buňky odčerpávají živiny a strukturní molekuly pro vlastní potřebu.
Kardiální kachexie je důsledkem pokročilých stadií chronického srdečního selhávání (hlavně pravostranného, které vede k anorexii vlivem stagnace, krve v játrech a střevech). Vlivem selhávání srdce se může vyvinout i porucha resorpce tuků a ztráta bílkovin střevní stěnou („protein-loosing enteropatie“). „Angina abdominalis“ jsou bolesti břicha, které způsobí nedostatečné prokrvení trávicího traktu po příjmu potravy. Příčinou je nedostatečné prokrvení vzhledem ke zvýšené potřebě kyslíku a živin při zátěži.