5.4 Fyziologie a patofyziologie endokrinních žláz
5.4.1 Klasické endokrinní žlázy
5.4.1.1 Hypotalamus
Hypotalamus je sběrným centrem informací. Soustřeďují se v něm informace z nervového, humorálního i imunitního systému o vnitřním prostředí organismu (má receptory pro monitorování teploty, koncentrace živin, hormonů, elektrolytů a vody), ale i o okolí (čichové vjemy, bolest), emocích a stresu. Tyto informace excitují či inhibují různé části hypotalamu a ovlivňují sekreci nejdůležitějších hormonů.
Faktory ovlivňující adenohypofýzu
V hypotalamu jsou produkovány a z něj jsou uvolňovány dva druhy hormonů s účinkem na sekreci hormonů adenohypofýzy (předního laloku hypofýzy): uvolňující hormony (Releasing Hormones – RH) čili liberiny a hormony inhibiční čili statiny. Každý hormon adenohypofýzy je řízen liberinem i statinem, ale ne všechny jsou stejně důležité. Klinicky jsou většinou významnější liberiny, snad jen u prolaktinu má větší význam statin (PIF – Prolaktin Inhibitory Factor).
Liberiny a statiny vznikají ve speciálních neuronech, uvolňují se do krve a jsou transportovány do předního laloku hypofýzy, kde stimulují produkci a sekreci hormonů adenohypofýzy.
Hormony související s neurohypofýzou
V paraventrikulárním a supraoptickém jádře hypotalamu vznikají hormony, které jsou nervovými vlákny (axonovým prouděním – neurokrinií) transportovány do neurohypofýzy a odtud jsou exocytózou uvolňovány do krevního oběhu. Jedná se o dva hormony: vazopresin (antidiuretický hormon) a oxytocin.
5.4.1.2 Hypofýza
Hypofýza (podvěsek mozkový) je žláza o průměru jednoho centimetru a hmotnosti půl gramu, uložená v tureckém sedle na lební bázi. Dělí se anatomicky i funkčně na dvě části: adenohypofýzu a neurohypofýzu. Mezi nimi je pars intermedia, která není u člověka klinicky významná.
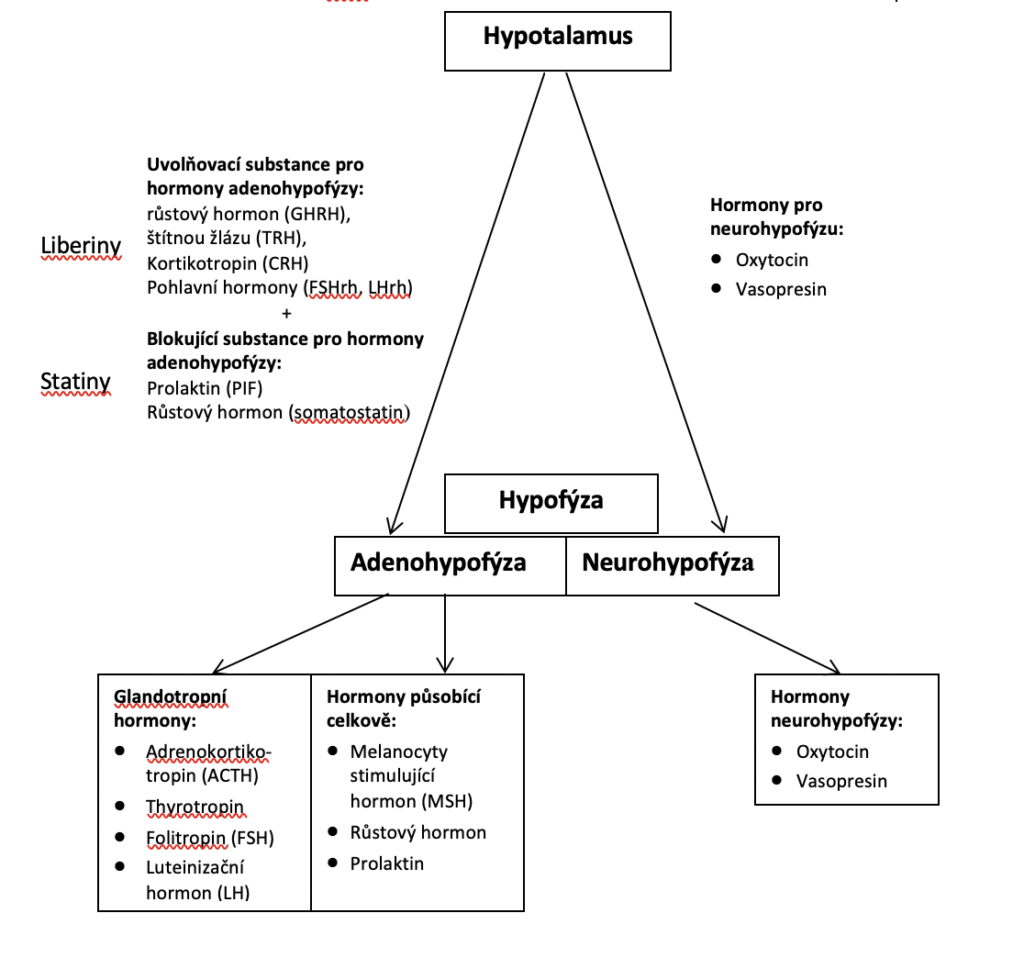
Adenohypofýza
Adenohypofýza je složena z několika druhů buněk. V eozinofilních buňkách vznikají celkově působící somatotropní hormon (STH) a prolaktin (PRL), v bazofilních buňkách vznikají ostatní hormony adenohypofýzy, které jsou glandotropní, tj. ovlivňují činnost jiných endokrinních žláz.
Neurohypofýza
Hormony neurohypofýzy vznikají v hypotalamu a neurokrinií (transportem nervovými vlákny) jsou transportovány do místa, kde jsou skladovány. Jedná se o dva peptidové hormony velmi podobného složení: vazopresin a oxytocin.
Adenohypofýza produkuje:
Růstový hormon
(SomatoTropní Hormon (STH), také Growth Hormone (GH)), jehož hlavní význam je v řízení metabolismu a růstu tkání. Je to velmi významný hormon bílkovinné povahy, který působí přímo na metabolismus všech buněk organismu. Na růst působí nepřímo, prostřednictvím somatomedinů (IGF- Insulin like Growth Faktorů), které se tvoří především v jaterní tkáni.
Sekrece STH je řízena z hypotalamu uvolňujícím a inhibujícím hormonem (GHRH a somatostatinem) a zvyšuje se hlavně ve spánku. Během dne jeho hladina kolísá v závislosti na aktivitě mozkové kůry. Sekreci ovlivňuje také koncentrace glukózy v plazmě (při snížení se STH zvyšuje) a stres, který ji zvýší. U dětí v dlouhodobém stresu se snižuje tvorba somatomedinů a děti rostou pomaleji.
Sekrece STH je řízena z hypotalamu uvolňujícím a inhibujícím hormonem (GHRH a somatostatinem) a zvyšuje se hlavně ve spánku. Během dne jeho hladina kolísá v závislosti na aktivitě mozkové kůry. Sekreci ovlivňuje také koncentrace glukózy v plazmě (při snížení se STH zvyšuje) a stres, který ji zvýší. U dětí v dlouhodobém stresu se snižuje tvorba somatomedinů a děti rostou pomaleji.
| STH má fyziologicky tyto účinky: • štěpí tuky (přímý lipolytický účinek – zdroj energie pro anabolismus); • podporuje růst svalové hmoty (pro svůj proteo-anabolický účinek byl zneužíván jako anabolikum); • snižuje zpracovávání glukózy (způsobuje, že zdrojem energie jsou volné mastné kyseliny, glukóza zůstává v krvi a zvyšuje glykémii); • podporuje růst pojivové tkáně, kostí a chrupavek; • podporuje retenci iontů sodíku, hořčíku, draslíku, vápníku a fosfátů |
Zvýšení sekrece STH
bývá nejčastěji způsobeno adenomem hypofýzy a projevuje se rozdílným klinickým obrazem podle toho, zda ke zvýšení sekrece došlo před uzavřením růstových chrupavek, či po něm (v dětství, nebo v dospělosti). Pokud se tvorba zvýšila před uzavřením růstových chrupavek, mluvíme o gigantismu. Projevuje se nadměrným vzrůstem (nad 220 cm) a je často provázen poruchami z nedostatku ostatních hormonů hypofýzy (hypofunkce z útlaku hypofýzy adenomem). Pacienti mívají také diabetes mellitus (vlivem na metabolismus cukrů) a hypertenzi (způsobenou retencí iontů a vody a hypertrofií srdce).
Při zvýšené tvorbě v dospělosti (po uzavření růstových chrupavek) rostou pouze akrální (okrajové) partie. Jde o akromegalii: zvětšení brady, nosu, nadočnicových oblouků, rukou, nohou a jazyka, ale také vnitřních orgánů (například srdce). Zhrubne hlas a projevují se též metabolické poruchy (diabetes mellitus, hypertenze). Pacient umírá na selhání srdce.
Snížení sekrece STH
má rovněž rozdílný klinický obraz podle toho, zda k němu došlo v dětství, či v dospělosti. Při snížení sekrece v dětství vzniká proporcionální porucha růstu (pacienti dosahují výšky kolem 120 cm) – jde o hypofyzární nanismus. Snížení sekrece STH v dospělosti urychluje stárnutí, zvyšuje úbytek svalové a kostní hmoty. Způsobuje také změny metabolismu živin a poruchu imunity.
V dospělosti bývá snížená sekrece STH spojena s poklesem sekrece všech hormonů adenohypofýzy (pan-hypo-pituitarismus). Příčinou je většinou autoimunitní zánět. Projevuje se nedostatečností nadledvin (klesá odolnost k zátěži), poklesem činnosti štítné žlázy, sníženou funkcí pohlavních orgánů a chybějící adaptační reakcí na chlad a nedostatek živin.
Prolaktin (PRL)
je hormon, který také působí přímo na tkáně bez prostřednictví další žlázy. Cílovými tkáněmi jsou hlavně buňky mléčné žlázy, tuková tkáň a buňky imunity. Jeho sekrece je řízena především PIF z hypotalamu (chemicky dopamin).
- během těhotenství stimuluje růst alveolů mléčné žlázy a připravuje ji na kojení
- po porodu odpovídá za tvorbu mléka
- způsobuje blokádu ovulace (přerušuje během kojení menstruační cyklus)
- má metabolické účinky, podobné STH. Nejdůležitější je lipolýza.
Prolaktin patří mezi stresové hormony, protože se jeho hladina při stresu významně zvyšuje. Tady je nejdůležitější jeho metabolický účinek a uvažuje se i o pravděpodobném účinku na aktivaci imunity. Bylo dokonce zjištěno, že je uvolňován nejen adenohypofýzou, ale i různými jinými buňkami, například aktivovanými lymfocyty.
Zvýšená sekrece prolaktinu (adenom nebo chronický stres, často snížená sekrece inhibitoru z hypotalamu) vede u žen nejčastěji k poruchám menstruačního cyklu, u mužů k poruchám libida a u obou pohlaví ke galaktoree (tvorbě mléka).
Adrenokortikotropní hormon (ACTH)
je typický glandotropní hormon. Jeho sekrece se zvýší složitou zpětnou vazbou (snížením produkce kortizolu) nebo stresovou reakcí a zvýšením CRH (Corticotropin Releasing Hormone) z hypotalamu. Působí na kůru nadledvin. Zvyšuje sekreci glukokortikoidů, nemá však přímý vliv na sekreci aldosteronu. (Pokud je však uvolňován dlouhodobě v nadbytku, způsobí hyperplazii kůry nadledvin s nadprodukcí všech produkovaných hormonů.)
ACTH vzniká v podobě velké molekuly pro-opio-melanokortinu (POMC – také se jí říká „Big Mama“), která se proteolyticky štěpí. Kromě ACTH tak vzniká několik menších hormonů:
- Lipotropiny, které mají slabé lipolytické účinky. Jejich hlavní význam však spočívá v tom, že se mohou přeměnit na β-endorfiny.
- β-endorfiny a met-enkefaliny jsou opioidní peptidy, které zmírňují bolest a mají euforizující účinky. Vyplavují se při stresu a při zátěži.
- Melanocyty stimulující hormon (MSH) pomáhá regenerovat sítnicové barvivo rhodopsin a v závislosti na slunečním záření ovlivňuje pigmentaci pokožky. U člověka má malý klinický význam, uvažuje se o jeho roli v řízení příjmu potravy. U nižších živočichů jde o významný hormon.
Zvýšená koncentrace ACTH působí troficky na kůru nadledvin a vede k její hyperplazii a hypersekreci kortizolu i aldosteronu (vzniká Cushingova choroba). Zvyšuje však také koncentraci MSH a pacient může mít zvýšenou pigmentaci.
Další hormony produkované adenohypofýzou:
- Tyreoideu stimulující hormon (TSH) řídí tvorbu a sekreci hormonů štítné žlázy.
- Folikuly stimulující hormon (FSH) podporuje u žen růst folikulů ve vaječnících před ovulací, u mužů spermiogenezi. Spolu s luteinizačním hormonem řídí funkci pohlavních žláz.
- Luteinizační hormon (LH) stimuluje u obou pohlaví sekreci pohlavních hormonů. U mužů se váže na receptory Leydigových buněk a stimuluje sekreci testosteronu, u žen stimuluje ovaria k sekreci estrogenů. Ve folikulární fázi menstruačního cyklu se náhle výrazně zvýší hladina LH a vyvolá ovulaci.
Nádor adenohypofýzy může produkovat velké množství některého z hormonů se všemi důsledky. Mechanicky však může současně utiskovat ostatní buňky a potlačit jejich sekreci. Nádor adenohypofýzy může také mechanicky vyvolávat další příznak – bitemporální hemianopsii. Adenohypofýza je totiž uložena nad křížením optických nervů, a pokud se zvětší, může útlak poškodit vlákna a vést výpadku periferních zorných polí.
Snížení funkce postihne většinou celou hypofýzu (adeno- i neurohypofýzu) a může vzniknout panhypopituitarismus. Vyskytuje se však vzácně. Příčinou může být autoimunitní zánět, úraz, ischemie nebo radiace. Pokud je spojen s poporodním krvácením, je tento stav nazýván Sheehanův syndrom.
Neurohypofýza produkuje:
Vazopresin (antidiuretický hormon – ADH)
Sekrece antidiuretického hormonu je řízena osmotickou aktivitou plazmy, kterou průběžně sledují osmoreceptory v hypotalamu. Při zvýšené osmolaritě (nedostatku volné vody v plazmě) se vyloučí ADH, který zabezpečí zvýšení zpětné resorpce volné vody v ledvinách. Sekrece ADH se zvyšuje také při stimulaci sympatiku (například při stresové reakci).
Fyziologické účinky ADH
- Zvyšuje propustnost sběracího kanálku a distálního tubulu v ledvinách pro volnou vodu zabudováním akvaporinů do jejich stěny. Zvyšuje její zpětnou resorpci, a tím snižuje množství vylučované vody močí – proto antidiuretický hormon (snižuje diurézu). Tím, že se zvýší resorpce volné vody, sníží se osmotická aktivita plazmy a naopak se zvýší osmolarita moči.
- Jako reakce na zvýšení aktivity sympatiku zvyšuje ADH napětí cévní stěny (vazokonstrikcí), tím zvyšuje krevní tlak – proto vazopresin.
Zvýšená sekrece – Syndrom Inadekvátní Sekrece ADH (SIADH) je méně častý. Projevuje se retencí volné vody, diluční hyponatrémií (normální množství sodíku je rozpuštěno ve větším množství vody, je tedy relativně snížena koncentrace Na+), slabostí a únavou. Díky snížené osmotické aktivitě plazmy může vzniknout i intracelulární otok mozku, projevující se bolestí hlavy až poruchami vědomí.
Snížená sekrece je klinicky častější – vzniká diabetes insipidus (úplavice močová, žíznivka). V důsledku snížené tvorby ADH se snižuje resorpce volné vody v ledvinách, zvyšuje se tvorba málo koncentrované moči a vzniká polyurie (až třicet litrů za den) a v důsledku ztrát tekutin nastane polydipsie (žíznivost). Život nemocného je ohrožen dehydratací.
Diabetes insipidus může být i důsledkem poruchy receptorů pro ADH. Může být vrozený, nebo vzniknout důsledkem chronické hypokalémie nebo hyperkalcémie.
Oxytocin
Sekrece oxytocinu je řízena přímo podrážděním příslušné hladké svaloviny stahem, na rozdíl od ostatních hormonů jde o pozitivní zpětnou vazbu.
Fyziologické účinky oxytocinu
- Vyvolává kontrakce dělohy na konci gravidity.
- Po porodu způsobuje ejekci mléka (kontrakcí myoepitelových buněk vývodů).
- U mužů usnadňuje ejakulaci.
- Má vliv na vývoj mateřského chování u všech savců včetně člověka.
Poruchy sekrece se projevují hlavně nedostatečnými kontrakcemi při porodu nebo poruchou mateřského chování.
Antidiuretický hormon i oxytocin ovlivňují také činnost mozku (mají neuro-modulační účinky). Oxytocin snižuje a antidiuretický hormon zvyšuje výbavnost paměťové stopy (zlepšuje paměť), oba však mají vliv i na chování.
5.4.1.3 Štítná žláza (glandula thyroidea)
Štítná žláza je umístěna na přední straně krku podél hrtanu a trachey. Tvoří ji dva laloky spojené můstkem. Buňky štítné žlázy vytvářejí folikuly, které jsou vyplněny jimi produkovaným koloidem. Velikost buněk i folikulů se mění podle funkčního stavu žlázy.
Pro činnost štítné žlázy je nezbytný jod, který je součástí hormonů. Jod je ve štítné žláze aktivně vychytáván z krve jodidovou pumpou, je oxidován na molekulární jod a poté je začleněn do organické vazby v molekule tyrozinu. Vzniká tak monojodtyrozin a dijodtyrozin, jejichž kondenzací vznikají hormony T3 a T4. Hotové hormony jsou uskladněny ve vazbě na tyreoglobulin ve folikulu a podle potřeby jsou uvolňovány do krve, kde jsou vázány na bílkoviny a transportovány do tkání. Cílovou tkání jsou všechny buňky organismu, v nichž se hormony vážou na receptory přímo v jádře buněk.
Sekrece T3 (trijodtyronin) a T4 (tyroxin) je řízena nabídkou jodu a řídicími hormony z hypotalamu a hypofýzy (tyreotropním hormonem – TRH a tyreoideu stimulujícím hormonem – TSH). Aktivní molekulou je T3, která vzniká za pomoci periferního enzymu štěpícího T4.
| Fyziologické účinky: Hlavní význam T3 je řízení bazálního u, růstu všech tkání v těle a vyzrávání CNS (intrauterinně a v dětství). • Zvyšuje bazální metabolismus ve všech tkáních, tím zvyšuje spotřebu kyslíku a vznik zbytkového tepla (ovlivňuje teplotu organismu); • Stimuluje proteosyntézu a růst; • Stimuluje metabolismus cukrů (využívá cukry jako zdroj energie pro zvýšený metabolismus), mění průběh glykemické křivky; • Zvyšuje mobilizaci a oxidaci tuků (další zdroj energie); • Má vliv na oběhový systém (zvyšuje citlivost a počet receptorů pro sympatikus v srdci: zvyšuje srdeční frekvenci a velikost minutového objemu; zajišťuje tak přísun kyslíku na krytí zvýšených metabolických potřeb); • Intrauterinně ovlivňuje diferenciaci nervové tkáně, později má vliv hlavně na rychlost vedení vzruchu. |
Poruchy sekrece hormonů štítné žlázy se většinou projeví zvětšením štítné žlázy – vznikem strumy (volete). Struma může vzniknout při hypofunkci (pak je velká, měkká a chladná), nebo při hyperfunkci (malá, tvrdá a horká ze zvýšeného prokrvení).
Hypertyreóza (hyperfunkce) se projevuje nesnášenlivostí tepla, pocením, úbytkem hmotnosti (způsobeno zvýšeným bazálním metabolismem), průjmy (ze zvýšené motility střev), nervozitou, jemným třesem, poruchami spánku a nervozitou (zrychlená aktivita CNS), svalovou slabostí a atrofií svalů (katabolismus), vzestupem srdeční frekvence (ze zvýšeného účinku katecholaminů). U mladých nemocných jsou častější nervové příznaky, u starších nemocných srdeční příznaky (často bývá jediným příznakem fibrilace síní). Pacientům navíc vypadávají vlasy a ztenčuje se kůže.
Graves Basedova choroba je způsobena protilátkami, které mají stimulační efekt na TSH receptory. Kromě strumy a tachykardie se u 30 % pacientů objevuje exoftalmus (vystouplé oční bulby) způsobené otokem a zmnožením retrobulbárního vaziva.
Tyreotoxická krize je vzácná a velmi závažná komplikace hypertyreózy. Pacientovi se náhle zvýší tělesná teplota nad 40°C, výrazně se zvýší srdeční frekvence a vyvine se arytmie. Stav je provázený zvracením a průjmem. Hrozí přehřátí, dehydratace a selhání srdce. Často se objeví výrazná svalová slabost.
Hypotyreóza má odlišný klinický obraz v dětství a v dospělosti. V raném dětství (od intrauterinního období přibližně do půl roku života) vede nedostatek hormonů štítné žlázy ke kretenismu, který se projevuje nevratnými (ireverzibilními) poruchami růstu a intelektu. Příčinou může být nedostatek jodu v potravě nebo nedostatek hormonů štítné žlázy během těhotenství matky. Dříve byl kretenismus častý ve vyšších geografických polohách, protože je tam nedostatek jodu ve vodě (endemický kretenismus na Valašsku nebo v Alpách, zvláště v Tyrolsku). Dnes je riziko menší, protože se jodiduje sůl.
Nedostatek hormonů štítné žlázy vzniklý v dospělosti je většinou způsoben autoimunitními záněty (např. Hashimotova tyreoiditis). Projevuje se slabostí a spavostí, nesnášenlivostí chladu, sníženým metabolismem, otylostí, zácpou, bradykardií (zpomalenou srdeční frekvencí), zpomalenými reflexy i myšlením (otupělostí), suchou kůží a myxedémem (zmnožením mukopolysacharidů v podkoží). V závažných případech může hypotyreóza vyústit v myxedémovou krizi: snížení tělesné teploty, těžká bradykardie s poruchou stažlivosti srdce a hypoventilace. Pacient je v nebezpečí smrti.
5.4.1.4 Kalcitropní hormony: kalcitonin, parathormon, vitamin D
Z celkového množství vápníku v těle je 99 % uloženo v kostech a zubech a jen 1 % v extracelulární tekutině. Metabolismus vápníku (kalcia), a tím i metabolismus kostní tkáně, je řízen třemi různými hormony: hormonem kalcitoninem, parathormonem (PTH) a vitaminem D, který se řadí mezi hormony, protože se teprve v těle přeměňuje na aktivní metabolit (kalcitriol).
Kalcitonin
vzniká v parafolikulárních buňkách štítné žlázy jako peptid. Jeho hlavní úlohou je ochrana kostní tkáně matky během těhotenství. Kalcitonin má jako jediný z kalcitropních hormonů receptory přímo na osteoblastech. V poslední době se má za to, že jeho další významnou úlohou je imunita.
Fyziologické účinky kalcitoninu
- inhibuje kostní resorpci a podporuje ukládání vápníku do kostí;
- tlumí vliv parathormonu na kost
- snižuje kalcémii
Sekrece kalcitoninu je řízena jednoduchou negativní zpětnou vazbou podle kalcémie, může být stimulována glukagonem i estrogeny (důkazem je zvýšení sekrece v těhotenství).
Parathormon
je nejdůležitějším regulátorem kalcémie. Je tvořen ve čtyřech příštítných tělískách (glandulae parathyroideae), která jsou uložena na zadní straně štítné žlázy. Sekrece parathormonu je řízena jednoduchou negativní zpětnou vazbou. Zvyšuje se při snížení kalcia v krvi. (Sekreci zvyšuje i hyperfosfatémie.) Hlavním úkolem parathormonu je rychlé zvýšení hladiny vápníku v krvi a její udržování. Nicméně bez přítomnosti vitamínu D parathormon kalcémii neudrží.
| Účinky parathormonu: • zvyšuje mobilizaci kalcia z kostí a tím udržuje kalcémii; • při fyziologické sekreci podporuje novotvorbu kosti (při dlouhodobě zvýšené sekreci zvyšuje odbourávání kostí), • zvyšuje zpětné vstřebávání kalcia v ledvinách; • snižuje vstřebávání fosfátů v ledvinách; • v ledvině působí na přeměnu neaktivního metabolitu vitaminu D na aktivní a tím nepřímo napomáhá resorpci vápníku ze střeva. |
Zvýšená sekrece parathormonu – hyperparatyreóza – je nejčastěji způsobena adenomem příštítného tělíska nebo hyperplazií (většinou všech tělísek). Vede k odbourávání kostí, vzniká osteoporóza a zvýšené riziko zlomenin. Projevuje se zvýšenou hladinou kalcia v plazmě. Zvýšená koncentrace kalcia stabilizuje buněčné membrány, pacient je unavený, má deprese a poruchy soustředění. Postupně se vyvíjí svalová únava (způsobená sníženou dráždivostí). Zvyšuje se stažlivost hladké svaloviny (stah hladkých svalů je závislý na extracelulárním kalciu) – pacient má hypertenzi a bolesti břicha (zvýšený tonus hladké svaloviny). Vápník se zvýšeně vylučuje ledvinami, vzniká osmotická polyurie, mohou se tvořit ledvinové kameny. Zvýšená koncentrace vápníku poškozuje tubuly ledvin a vzniká diabetes insipidus, končící po letech chronickým selháním ledvin.
Snížení sekrece parathormonu – hypoparatyreóza – vzniká nejčastěji autoimunitním zánětem příštítných tělísek. Často se vyskytuje spolu s diabetem mellitem prvního typu.
Projevuje se sníženou hladinou kalcia v plazmě a v důsledku toho zvýšenou nervosvalovou dráždivostí (hypokalcemická tetanie: jedním z prvních projevů jsou karpopedální spazmy – křeče malých svalů ruky a nohy). Opět se vyskytují poruchy CNS (deprese, poruchy kognice i chování, zřejmě je to dáno změnou dráždivosti buněk). Stejný obraz má pseudohypoparatyreóza, tedy stav necitlivosti cílových tkání na parathormon. (Hladina parathormonu je normální či zvýšená.)
Vitamin D (kalcitriol)
Kalcitriol zvyšuje hladinu kalcia v krvi. Posiluje a doplňuje účinky parathormonu, proto je při nedostatku kalcia parathormonem v ledvinách aktivován.
| Vitamin D vzniká v kůži ze 7-dehydrocholesterolu vlivem slunečních UV paprsků (takto vzniklý vitamin D se nazývá cholekalciferol), nebo je přímo získáván z potravy jako v tucích rozpustný vitamin ergokalciferol (rybí tuk, ryby). V játrech se dále metabolizuje na málo aktivní 25-OH-kalciferol a ten je za přítomnosti parathormonu v ledvinách metabolizován na velmi aktivní 1,25-dihydroxykalciferol (kalcitriol). |
Účinky vitaminu D:
- zvyšuje resorpci vápníku a fosfátů ve střevě;
- zvyšuje ukládání kalcia do novotvořených kostí a usnadňuje vstřebávání vápníku z kostí odbourávaných;
- má význam pro imunitu, hojení atd.
Nedostatek vitamínu D vede v dětství ke křivici (rachitis). Děti pomalu rostou, dlouhé kosti jsou měkké z nedostatečné kalcifikace a křiví se. Děti mají velkou hlavu a měkké zátylí. Na rukou a nohou jsou patrné rozšířené epifýzy (růstové chrupavky, které rostou normálně). Děti mívají velká bříška a často trpí křečemi z hypokalcémie.
V dospělosti vede nedostatek vitamínu D k osteomalácii. Ubývá anorganické matrix kosti, kosti jsou křehké a snadno se lámou. Kost se nově netvoří, vzniká jen organická matrix.
| PTH | Kalcitriol | Kalcitonin | Kortizol, (T3, Il 1, Il 6) | |
| Resorpce kostí | ↑ resorpci | ↑ mineralizaci kostí | ↓resorpci kosti | ↑ resorpci kostí |
| Resorpce Ca2+ v ledvinách | ↑ resorpci vápníku a ↓resorpce fosfátů | ? (zvyšuje resorpci vápníku i fosfátů) ? | – | – |
| Resorpce Ca2+ ve střevech | nepřímo | zvyšuje resorpci vápníku i fosfátů | – | ↓resorpci vápníku i fosfátů |
| Vzájemné vlivy | Podporuje v ledvinách přeměnu vitamínu D na nejaktivnější formu | Snižuje sekreci PTH přímo i nepřímo zvýšenou kalcémií | Snižuje účinek PTH na kost | Snižuje účinek vitamínu D ve střevě, zvyšuje sekreci PTH |
5.4.1.5 Hormony slinivky břišní (pankreatu)
Pankreas (slinivka břišní) je žláza s endokrinní a exokrinní sekrecí. Stavbou připomíná slinnou žlázu. Její vnitřně sekretorickou částí jsou Langerhansovy ostrůvky umístěné difuzně ve tkáni žlázy. Jsou tvořeny buňkami A, které produkují glukagon, buňkami B syntetizujícími inzulin a buňkami D, v nichž vzniká somatostatin a gastrin. Exokrinní sekreci tvoří aciny produkující trávicí enzymy vylučované vývodem do duodena.
Inzulín
Inzulín je hormon bílkovinné povahy, tvořený dvěma polypeptidovými řetězci spojenými disulfidickými můstky. Jeho aktivní metabolit obsahuje zinek. Sekrece je řízena jednoduchou zpětnou vazbou: zvýšená glykémie zvýší sekreci inzulínu. Kromě toho sekreci inzulínu zvyšuje stimulace vagu (neurogenní stimulace), gastrin, sekretin a somatotropní hormon. Hlavní funkcí inzulínu je snížit glykémii a zvýšit využití (utilizaci) glukózy.
| Inzulín fyziologicky • snižuje glykémii: zvyšuje prostupnost buněčných membrán pro glukózu a „uklízí“ glukózu do buněk; • v buňkách zvyšuje aktivitu enzymů, které zodpovídají za zpracování glukózy (zvyšuje tak tvorbu glykogenu a v tukových buňkách zvyšuje tvorbu tuků); • snižuje katabolismus tuků a bílkovin; • napomáhá růstu (umožňuje vstup aminokyselinám do buněk); • aktivuje Na/K pumpu a pomáhá přestupu draslíku do buněk. Změnou kalémie ovlivňuje klidový membránový potenciál. |
Zvýšená sekrece inzulínu (způsobená například nádorem produkujícím inzulin) se projevuje snížením glykémie (hypoglykémií) a podle její výše těmito příznaky: pacient má hlad (při dlouhodobé lehké hypoglykémii vzniká postupně obezita); při rychlém průběhu může být zmatený, slabý, ospalý, může mít až psychiatrické příznaky nebo upadnout do bezvědomí (příznaky jsou vyvolané nedostatkem glukózy v CNS, protože glukóza je jediným zdrojem energie pro mozek). Kromě toho se může objevit třes, pocení a bledost, které vznikají v důsledku aktivace sympatiku. Aktivace sympatiku kompenzuje hypoglykémii vyplavením stresových hormonů (adrenalin i kortizol glykémii zvyšují). Bez pomoci vede hypoglykémie rychle k bezvědomí a smrti.
Snížená sekrece nebo necitlivost tkání k inzulínu se projevuje souborem příznaků pojmenovanýchdiabetes mellitus (úplavice cukrová). Jde o poruchu metabolismu cukrů s laboratorním nálezem hyperglykémie (zvýšené hladiny glukózy v plazmě). Příčinou tohoto stavu může být nedostatečná produkce inzulínu (diabetes mellitus 1. typu) nebo snížená citlivost receptorů pro inzulín (DM 2. typu).
Obecně se u diabetu vyvíjejí tyto příznaky: zvýšená hladina glukózy v krvi (hyperglykémie), vylučování glukózy močí (pokud glykémie překročí ledvinový práh 10 mmol/l – glykosurie). Zvýšená osmolarita a osmotickou polyurií způsobená dehydratace vedou k žízni (polydipsii). Snížená utilizace glukózy změní metabolismus tuků (zvýšené odbourávání tuků: zvýšení LDL, VLDL – rozvoj aterosklerózy). Poškozeny jsou i myelinové pochvy nervů (klinicky se projevuje diabetickou polyneuropatií). Porucha bílkovin (glykace) a jejich zvýšené odbourávání způsobuje zhoršené hojení ran. Pacient je ohrožený častými infekcemi.
Při zvýšeném odbourávání tuků za nepřítomnosti inzulínu (DM 1.typu) se tvoří kyselé ketolátky (aceton, kyselina acetoctová a kyselina β-hydroxymáselná) a vzniká porucha acidobazické rovnováhy.
Glukagon
se tvoří v alfa buňkách pankreatu. Jeho sekrece je opět řízena jednoduchou zpětnou vazbou: vyplavuje se při snížení hladiny glukózy v krvi. Sekrece se však zvyšuje i při fyzické zátěži organizmu a stresu.
| Hlavní funkcí je zvyšování glykémie: • zvyšuje glykémii zvýšením glykogenolýzy v játrech (ne ve svalech); • zvyšuje glukoneogenezi (tvorbu glukózy z glycerolu a aminokyselin); • zvyšuje sekreci inzulínu. Glukagon a inzulin se funkčně doplňují a společně udržují fyziologickou koncentraci glukózy. |
Zvýšená sekrece bývá způsobena adenomem (glukagonom), který vede k sekundárnímu diabetu mellitu (hyperglykémie se všemi důsledky).
- Pankreatický somatostatin je po chemické stránce totožný se složením somatostatinu řídícímsekreci růstového hormonu. Hladinu somatostatinu zvyšuje hyperglykémie, aminoacidémie, zvýšená hladina mastných kyselin a navíc i některé z gastrointestinálních hormonů. Jeho hlavním úkolem je
- (parakrinně) blokovat sekreci inzulínu i glukagonu;
- zpomalit motilitu žaludku, duodena a žlučníku;
- snížit sekreci gastrinu v žaludku;
- snížit sekreci, resorpci a motilitu v celém trávicím traktu.
Zvýšená sekrece bývá způsobena somatostatinem, což je vzácný maligně se chovající nádor. Pozdními příznaky jsou hyperglykémie, dyspepsie s průjmy, bolesti břicha a malabsorpční syndrom.
Pankreatický gastrin. Gastrin se tvoří hlavně v žaludku a duodenu, část se tvoří také v pankreatu. Gastrin obecně zvyšuje sekreci žaludeční šťávy a motilitu žaludku. Podle některých autorů zvyšuje pankreatický gastrin parakrinně sekreci glukagonu. Účelem je zajistit zvýšením glykémie po požití potravy dostatek energie pro práci trávicího traktu ještě před vstřebáním glukózy ze střeva.
Zvýšená sekrece gastrinu (při gastrinomu) zvyšuje především sekreci HCl v žaludku. Velké množství kyselé žaludeční šťávy se dostává do duodena, kde poškozuje stěnu (vznikají duodenální vředy) a denaturuje pankreatické enzymy. Nedostatek trávicích enzymů způsobí průjmy a malabsorpční syndrom.
5.4.1.6 Nadledviny – dřeň a kůra
Nadledviny jsou párové vnitřně sekretorické žlázy, uložené nad horním pólem ledvin. Každá z nich je rozdělena na dvě funkčně samostatné žlázy: dřeň nadledvin a kůru nadledvin.
Dřeň nadledvin
je přeměněné ganglion sympatiku, které syntetizuje katecholaminy adrenalin a noradrenalin. Sekrece je ovlivňována pregangliovými vlákny sympatiku, která dřeň inervují. Tuto sekreci posiluje jakákoli zátěž nebo stres: cvičení, hypoglykémie, trauma a další. Adrenalin a noradrenalin jsou základní stresové hormony (jejich hladina se při poplachové reakci výrazně zvyšuje). Noradrenalin je současně mediátorem sympatiku.
V menším, avšak pro život zcela dostačujícím množství, jsou katecholaminy produkovány také v sympatických gangliích a v mozku, takže dřeň nadledvin není pro život nezbytná.
Katecholaminy
mají receptory na povrchu buněk. Receptorů je více typů, proto mají v různých tkáních různé účinky. Zjednodušeně se dá říci, že α-receptory mají spíše stimulující (např. vazokonstrikční účinek), β-receptory efekt inhibující (inhibují tonus ve svalovině bronchů, čímž způsobují bronchodilataci, v močovém měchýři zvyšují poddajnost). V srdci však mají beta (β1) receptory aktivační účinek.
| Účinky adrenalinu: • na myokard působí pozitivně inotropně, chronotropně, dromotropně a bathmotropně (zvyšuje stažlivost, frekvenci, vodivost a dráždivost srdečního svalu), což vede ke zvýšení srdečního výdeje a systolického tlaku; • rozšiřuje bronchy, má bronchodilatačnční účinek • aktivuje dechová centra – způsobuje hyperventilaci • aktivuje glykogenolýzu v játrech a zvyšuje sekreci glukagonu (zvyšuje glykémii a současně snižuje sekreci inzulínu a citlivost jeho receptorů); zvyšuje utilizaci kyseliny mléčné; • snižuje sekreci a motilitu trávicího traktu • zvyšuje poddajnost močového měchýře. |
| Účinky noradrenalinu (převažují stimulující účinky): • pozitivně inotropní efekt v srdci (zvyšuje systolický tlak) • zvyšuje srdeční frekvenci • vazokonstrikce ve svalech, zvyšuje diastolický krevní tlak; podpora katabolismu lipidů. |
Následky snížení tvorby adrenalinu a noradrenalinu nejsou známy ani po odstranění nadledvin.
Zvýšení tvorby adrenalinu bývá většinou způsobeno hormonálně aktivním nádorem nadledvin feochromocytomem. Velké množství adrenalinu se projevuje vysokým krevním tlakem (aktivace sympatiku), zrychlenou srdeční akcí, bledostí, studeným potem, bolestmi hlavy, nervozitou, třesem a slabostí. Tyto stavy přicházejí záchvatovitě, mohou však přejít do trvalé hypertenze. Známkou zvýšené sekrece a odbourávání katecholaminů je přítomnost kyseliny vanilmandlové v moči.
Kůra nadledvin
produkuje třicet steroidních hormonů, které vznikají z cholesterolu. Jde o tzv. mineralokortikoidy (hlavní představitel aldosteron), glukokortikoidy (hlavní představitel kortizol) a pohlavní hormony (dehydroepiandrosteron, androgeny a méně estrogeny a progesteron). Histologicky lze v kůře rozlišit: zona glomerulosa, která produkuje aldosteron, zona fasciculata a zona reticularis, v nichž se tvoří glukokortikoidy a pohlavní hormony.
Dehydroepiandrosteron (DHEA)
je po cholesterolu nejvíce zastoupená látka steroidního původu v plazmě. Byl prokázán jeho účinek na imunitní děje, proti rakovině, stárnutí a obezitě. Byly u něj prokázány i neuromodulační účinky.
Mineralokortikoidy
Aldosteron je pro život nezbytný. Jeho hlavní funkcí je řízení metabolismu vody a draslíku. Jeho sekrece je regulována hlavně prokrvením ledvin. Při nedostatečném průtoku krve ledvinami (většinou při sníženém objemu krve) se v juxtaglomerulárním aparátu ledvin začne tvořit renin, který aktivuje krevní bílkovinu angiotenzinogen na angiotenzin I. Angiotenzin I se v plicích aktivuje na angiotenzin II, který mohutně stimuluje sekreci aldosteronu (osa RAAS). Kromě toho je sekrece aldosteronu řízena také koncentrací draslíku (zvýšená kalémie zvyšuje sekreci aldosteronu). Vliv ACTH na sekreci aldosteronu je za fyziologických okolností nepatrný.
| Hlavní funkcí aldosteronu je metabolismus minerálů a vody, udržování krevního objemu a tlaku. • zadržuje v těle sodík (Na+) a s ním i vodu (v distálním tubulu a sběracím kanálku ledvin); • zvyšuje vylučování draslíku (K+) a vodíku (H+) do moči; • udržuje krevní tlak udržováním objemu intravazální tekutiny. Přispívá k tomu i vazokonstrikční účinek angiotenzinu a myogenní reflex cévní stěny vyvolaný zvýšenou náplní. |
Snížení sekrece aldosteronu bývá většinou společně se snížením sekrece kortizolu způsobeno autoimunitním poškozením kůry nadledvin – viz Addisonova choroba.
Zvýšení sekrece aldosteronu, primární hyperaldosteronismus (Connův syndrom), je charakterizovaný zadržováním sodíku a vody, což zvyšuje krevní tlak (vzniká hypertenze). Dále pacient ztrácí velké množství draslíku a vzniká metabolická alkalóza ze ztrát vodíku.
Glukokortikoidy
Kortizol je hormon, jehož nedostatek nevede bezprostředně ke smrti, ale při jeho nepřítomnosti není organizmus schopen reagovat na jakoukoli zátěž nebo stres. Sekrece kortizolu je řízena komplexní zpětnou vazbou adrenokortikotropním hormonem (ACTH) z adenohypofýzy a CRH z hypotalamu. Je také stimulována stresem. Kortizol je spolu s adrenalinem a noradrenalinem hlavní stresový hormon.
| Kortizol má několik účinků: • stimuluje glukoneogenezu; metabolismus cukrů podporuje na úkor proteinů; • zvyšuje katabolismus bílkovin (glukoplastické aminokyseliny slouží jako substrát pro glukoneogenezu); • aktivuje lipolýzu: do krve se vyplavují mastné kyseliny (přímý zdroj energie) a glycerol (substrát pro glukoneogenezu); • snižuje využití glukózy ve svalech tím, že snižuje citlivost periferních receptorů pro inzulín; • působí protizánětlivě (neumožnuje tvorbu peptidových a bílkovinných molekul, které řídí zánět, zvyšují permeabilitu kapilár a migraci a fagocytózu neutrofilních granulocytů); • má antialergický a imunosupresivní účinek; • účastní se na intrauterinním vyzrávání plic a tvorbě surfaktantu; • v nadbytku má mineralokortikoidní účinky (zvyšuje krevní tlak a vylučování draslíku močí); • zvyšuje odbourávání kostí a snižuje vstřebávání vápníku ve střevě; • při stresu udržuje sekrece glukokortikoidů zvýšenou sekreci adrenalinu a noradrenalinu ze dřeně nadledvin. |
Zvýšení sekrece glukokortikoidů, hyperkortizolismus působí osteoporózu v kostech (snížením resorpce vápníku v trávicím traktu a přímou i nepřímou podporou sekrece parathormonu), ztenčuje kůži, stimuluje sekreci kyseliny chlorovodíkové v žaludku (vznikají „stresové“ žaludeční vředy) a způsobuje steroidní diabetes mellitus (má diabetogenní účinek).
Zvýšená sekrece může být primární (adenom se zvýšenou produkcí kortizolu – Cushingův syndrom), nebo sekundární (nadprodukce ACTH s hyperplazií kůry nadledvin a zvýšenou sekrecí kortizolu i aldosteronu – Cushingova choroba). Nadměrný přívod glukokortikoidů z léčebných důvodů vede k témuž obrazu. Klinicky se tato choroba projevuje obezitou, měsícovitým obličejem, tenkými končetinami, chabými svaly, tenkou kůží se striemi (pajizévkami) a zhoršeným hojením ran (důsledek proteokatabolismu), hyperglykémií (ze zvýšené glukoneogeneze), osteoporózou, hypertenzí a poruchami iontového metabolismu (zadržováním sodíku a z toho plynoucím vzestupem tlaku krve a vylučováním draslíku).
Snížení sekrece mineralokortikoidů a glukokortikoidů (Addisonova choroba) je většinou způsobena autoimunitním zánětem. Způsobí současný nedostatek aldosteronu i kortizolu. Klinicky se projevuje ztrátami sodíku a tekutin, poklesem krevního tlaku a vzestupem hladiny draslíku. Při zátěži se snižuje glykémie, pacient je slabý a hrozí rozvoj šoku. U primárního onemocnění (onemocnění nadledvin) se vlivem zpětné vazby zvyšuje produkce ACTH a MSH, takže je klinický obraz doplněn pigmentacemi kůže. U sekundárního onemocnění (snížená produkce ACTH nestimuluje sekreci z nadledvin) pigmentace nejsou.
Při vrozeném enzymatickém defektu tvorby kortizolu se zvyšuje sekrece adrenokortikotropního hormonu z adenohypofýzy, což způsobí hyperplazii kůry nadledvin. Protože sekrece kortizolu je nemožná, zvyšuje se sekrece pohlavních hormonů zde produkovaných (hlavně androgenů) a dochází k virilizaci plodu ženského pohlaví (vzniká pseudohermafroditismus femininus externus: plod má sice ženský genotyp (genetickou výbavu), ale mužský fenotyp (vzhled). U plodu mužského pohlaví vzniká předčasná puberta – pubertas praecox.